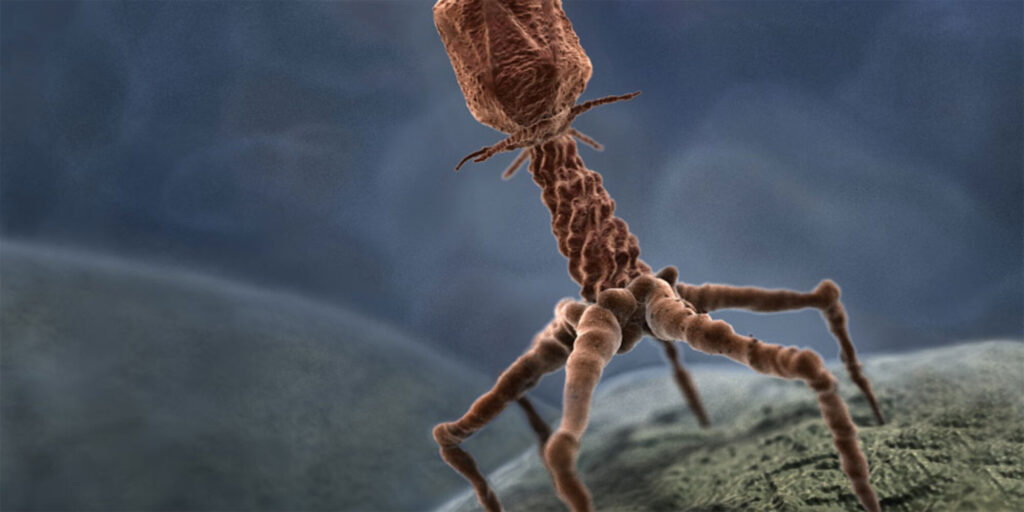
Bacteriófagos: los virus que pueden salvar vidas
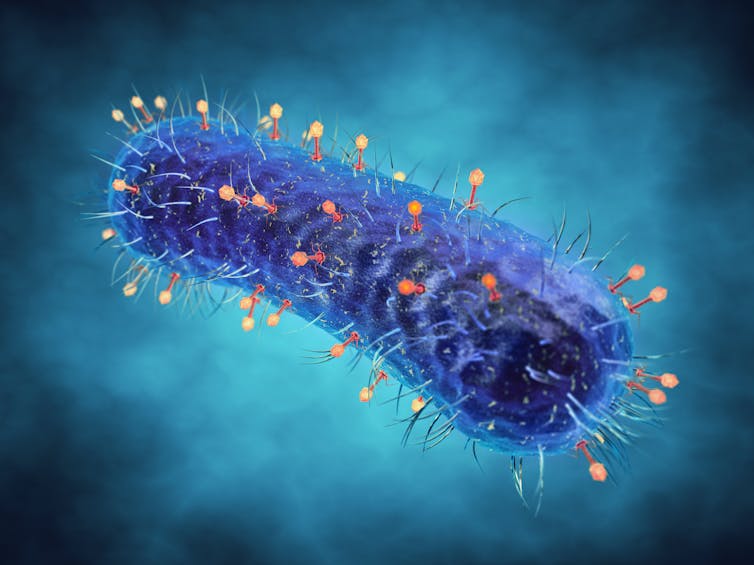
Vivimos una pandemia que ha afectado a millones de personas, quebrantado innumerables sistemas de salud y economías y destrozado la reputación de los virus. No quiero decir que antes de conocer al SARS-CoV-2 los virus fueran santos de nuestra devoción. La sociedad ya los reconocía como los responsables de enfermedades como el sarampión, la hepatitis y el sida. Hoy por hoy, sin embargo, el miedo y la furia contra estos microbios parecen más grandes que nunca.
Aquí intentaré aclarar que no todos los virus son malos. De hecho, en nuestro laboratorio trabajamos con virus que pueden algún día salvarnos la vida. Se llaman bacteriófagos.
Antes de explicar qué hace a los bacteriófagos nuestros aliados, revisaré tres de sus similitudes con otros virus:
Su estructura es bastante simple. No son más que unas cuantas hebras de material genético protegidas por una carcasa hecha de proteínas.
Es difícil considerarlos vivos. Por sí solos, los virus son incapaces de multiplicarse. Necesitan atacar y secuestrar una célula.
Son muy quisquillosos. Cada virus es capaz de infectar solamente a un tipo muy reducido y específico de células.
En esta última característica radica la principal diferencia. Los bacteriófagos no pueden infectar células humanas. Ellos, exclusivamente, matan bacterias.
Bacterias y resistencia a antibióticos
Las bacterias también son organismos microscópicos, pero son mucho más complejos que los virus. Aunque son responsables de un amplia gama de infecciones, suponen una especial preocupación en el ambiente hospitalario.
La enorme mayoría de infecciones asociadas a la atención en salud son causadas por bacterias: desde infecciones de heridas quirúrgicas a aquellas del tracto urinario y el torrente sanguíneo. Cuando un paciente hospitalizado adquiere una infección bacteriana, sus probabilidades de fallecer aumentan drásticamente.
Hasta hace un par de décadas las infecciones bacterianas no resultaban preocupantes. Con la dosis adecuada del antibiótico correcto, los pacientes emprendían una rápida recuperación.
Una de las amenazas más grandes a las que el mundo se enfrenta actualmente es la resistencia a antibióticos. Las bacterias se han vuelto capaces de resistir hasta nuestros antibióticos más potentes. Necesitamos nuevas estrategias para ayudar a pacientes con estas infecciones. Aquí entran los bacteriófagos.
Fagoterapia: el enemigo de mi enemigo es mi amigo
Parecería una escena sacada de una película de ciencia ficción.
Un paciente hospitalizado sufre una infección bacteriana generalizada. Se encuentra en cuidados intensivos, en estado de coma, y sus médicos han agotado los posibles tratamientos antibióticos. El pronóstico es desalentador.
Una última esperanza: el equipo médico propone administrar billones de virus directamente a la circulación del paciente. Pero no cualquier virus: bacteriófagos que han sido cuidadosamente seleccionados en el laboratorio para matar a la bacteria que está infectando al paciente.
Tras pocos días de tratamiento, el paciente despierta. Los virus están ganando la batalla a las bacterias. El enemigo de mi enemigo es mi amigo.
En los últimos cinco años, múltiples variaciones de esta historia se han publicado en las revistas científicas más importantes. Los casos incluyen infecciones en los huesos, prótesis, implantes y heridas, además de neumonías, sepsis e infecciones urinarias. Hasta las bacterias más peligrosas y resistentes, según la Organización Mundial de la Salud, han sucumbido en casos puntuales a los bacteriófagos.
Aliados antiguos, versátiles y prometedores
Aunque la fagoterapia celebró hace poco su primer centenario, nuestro interés en ella ha crecido exponencialmente en la última década, debido principalmente a la emergencia de la resistencia a antibióticos. Una nueva ola de descubrimientos ha dejado en claro que los bacteriófagos son aliados versátiles y prometedores.
Por ejemplo, en enero publicamos nuestra observación de bacterias que pueden volverse resistentes a la fagoterapia. Reportamos, sin embargo, que cuando lo hacen pierden la resistencia que solían tener a varios antibióticos. Concluimos que con los bacteriófagos correctos podemos poner a las bacterias entre la espada y la pared. Combinar bacteriófagos con antibióticos podría extender nuestro arsenal terapéutico.
Por otro lado, grupos de investigación exploran el diseño de cócteles de bacteriófagos. Al mezclar varios virus en una sola preparación, podemos mejorar su espectro de acción.
Otros, estudian proteínas específicas producidas por bacteriófagos. Usar solamente estas proteínas, en lugar del virus entero, podría facilitar su producción a gran escala.
Usando técnicas de bioingeniería, científicos han logrado modificar bacteriófagos para que ataquen bacterias contra las que no se han podido aislar virus naturales.
Y la lista sigue creciendo.
El futuro de la fagoterapia
Mientras más descubrimos acerca de los bacteriófagos, surgen más preguntas que debemos responder con respecto a la fagoterapia.
Los casos clínicos individuales exitosos son alentadores, pero necesitamos establecer ensayos clínicos controlados a gran escala. A marzo del 2021, están activos al menos 12 ensayos clínicos de fagoterapia alrededor del mundo. Seguro que sus resultados nos brindarán lecciones importantes.
El perfil de seguridad de los bacteriófagos es positivo. No hay evidencia de reacciones alérgicas, como puede suceder con los antibióticos. Sin embargo, debemos conocer más a fondo sus interacciones con células humanas, y con las bacterias que infectan.
Desde el punto de vista práctico, es necesario establecer las dosis y vías de administración óptimas. Vale la pena intentar descubrir las combinaciones más favorables con antibióticos. Finalmente, debemos construir el marco legal necesario para la regulación de su uso.
Esta es una historia en desarrollo. Y mientras seguimos explorando este apasionante campo, espero que recordemos que no todos los virus son malos. Los bacteriófagos pueden salvar vidas.
Fernando Gordillo-Altamirano, Medical Doctor, PhD Student, School of Biological Sciences, Monash University
Este artículo fue publicado originalmente en The Conversation. Lea el original.
Comparte esto:
- Entrada
- Compartir en Threads (Se abre en una ventana nueva) Threads
- Compartir en WhatsApp (Se abre en una ventana nueva) WhatsApp
- Compartir en Reddit (Se abre en una ventana nueva) Reddit
- Compartir en Telegram (Se abre en una ventana nueva) Telegram
- Compartir en Mastodon (Se abre en una ventana nueva) Mastodon
- Compartir en Bluesky (Se abre en una ventana nueva) Bluesky